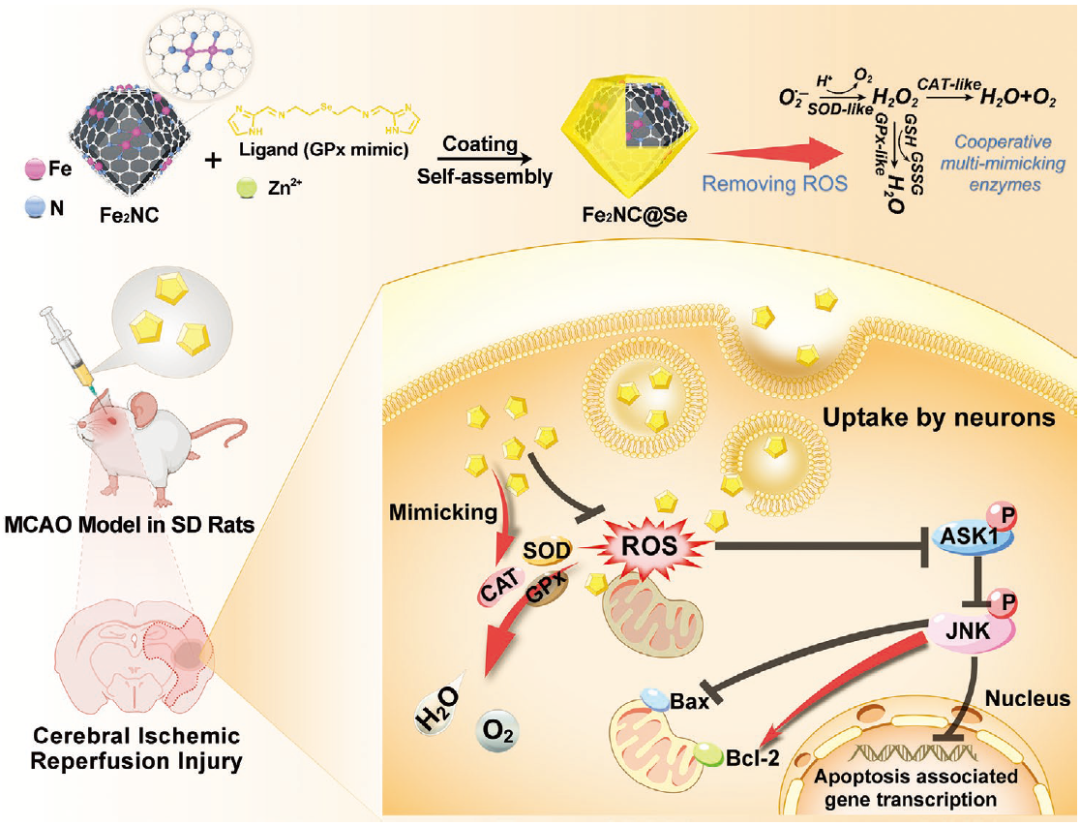
原子级单分散双原子纳米酶不仅具有活性中心均一、原子利用率高等优点,而且与单原子纳米酶相比,双原子组分在催化活性方面表现出惊人的协同效应。此类材料在构建具有多酶级联能力的双原子纳米酶来保护脑组织免受损伤方面虽然极具前景,但目前仍然是一个巨大的挑战。
在脑缺血再灌注期间,活性氧(ROS)的产生会爆炸性提高,从而可能对脑组织造成的继发性损伤。有鉴于此,杭州师范大学刘俊秋教授、孙鸿程副教授、吉林大学第一医院杨弋教授和吉林大学白福全教授等人通过将双Fe原子纳米酶(Fe2NC)封装在含硒MOF(Se-MOF)壳层中,构建了多酶级联抗氧化系统(Fe2NC@Se纳米酶)。与单原子Fe纳米酶(Fe1NC)相比,研究所设计的双Fe原子纳米酶具有更高的类超氧化物歧化酶(SOD)、类过氧化氢酶(CAT)甚至类氧化酶(OXD)活性。此外,Se-MOF壳层不仅可以模拟谷胱甘肽过氧化物酶(GPx)的作用,还能够明显提高Fe2NC纳米酶的稳定性和生物相容性。密度泛函理论计算表明,Fe2NC的协同效应是活性提高的主要原因。体内外实验结果则显示,该多功能抗氧化Fe2NC@Se纳米粒子可通过有效清除细胞内ROS和潜在抑制ASK1/JNK凋亡信号通路,以在脑缺血再灌注损伤后抵抗氧化损伤和抑制神经细胞凋亡。相关工作以“Se-Containing MOF Coated Dual-Fe-Atom Nanozymes With Multi-Enzyme Cascade Activities Protect Against Cerebral Ischemic Reperfusion Injury”为题发表在Advanced Functional Materials。